Pour réaliser cette expérience, chaque groupe disposait
de:
-14 tubes à essai de même diamètre
-support double de tubes à essai
-6 burettes
-6 béchers de 100 mL
-6 pots en verre
Les produits utilisés lors du dosage du fer sont :
-thiocyanate de potassium à 200 g/L
-acide chlorhydrique dilué à
demi
-solution d' ions fer III à 5.10-2
g/L en ions Fe3+
-vin blanc
-eau oxygénée à 5 volumes
- eau distillée
Nous rappelons que l' ion thiocynate donne avec l' ion fer III un ion
complexe de couleur rouge:
Fe3++ SCN-
--> FeSCN2+
Pour une même quantité d' ion thiocyanate, l' intensité
de la coloration dépend de la quantité d' ions fer III. On
va réaliser une échelle de teinte correspondant à
diverses concentrations en ions fer III et déterminer à partir
de cette échelle la concentration en fer d' un vin blanc.
Afin de doser le fer total, on ajoute:
-de l' acide chlorhydrique concentré qui
transforme en chlorures trés dissociés les sels complexes
du vin
-de l' eau oxygénée qui oxyde les
ions fer II en ions fer III
-des ions thiocyanates qui donnent une coloration
plus ou moins intense suivant la concentration en fer
On remarque qu' un volume de 1 mL de la solution de fer III apporte
5.10-2 mg de fer
teneur en fer = nombre de mg/ nombre de mL= 0,05/ 13= 0,0038 mg/mL=3,8mg/L.
Manipulations:
Dans 10 tubes à essais numérotés de 1 à
11, verser, dans l'ordre indiqué ci-dessous :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3, 8 |
|
Résultats
• Déterminer la concentration totale en fer du
vin en comparant la couleur obtenue dans le tube n°11 avec celle des
tubes étalons.
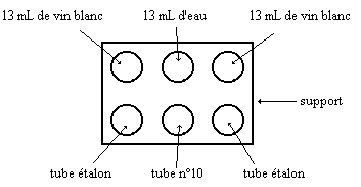
La comparaison s'effectue en utilisant un support de
tubes double dans lequel on place les tubes à essais comme sur le
schéma ci dessous. On observe les tubes de façon horizontale,
face au tube n°11, devant un fond blanc bien éclairé.
